李博安教授團隊開(kāi)發基于CRISPR/Cas12a不受PAM限制的一(yī)步法核酸快檢技術
近幾十年來,由病原體(tǐ)百日咳杆菌(BP)、流感病毒、SARS-CoV-2等引起的呼吸道傳染病嚴重威脅着人類健康,尤其是2019年爆發的2019年冠狀病毒病(新冠肺炎)。核酸的快速、早期和準确檢測對于疾病的診斷、治療方案的評估、預防措施的制定、耐藥性的評估等具有重要意義,這反過來可以防止疾病傳播的風險。
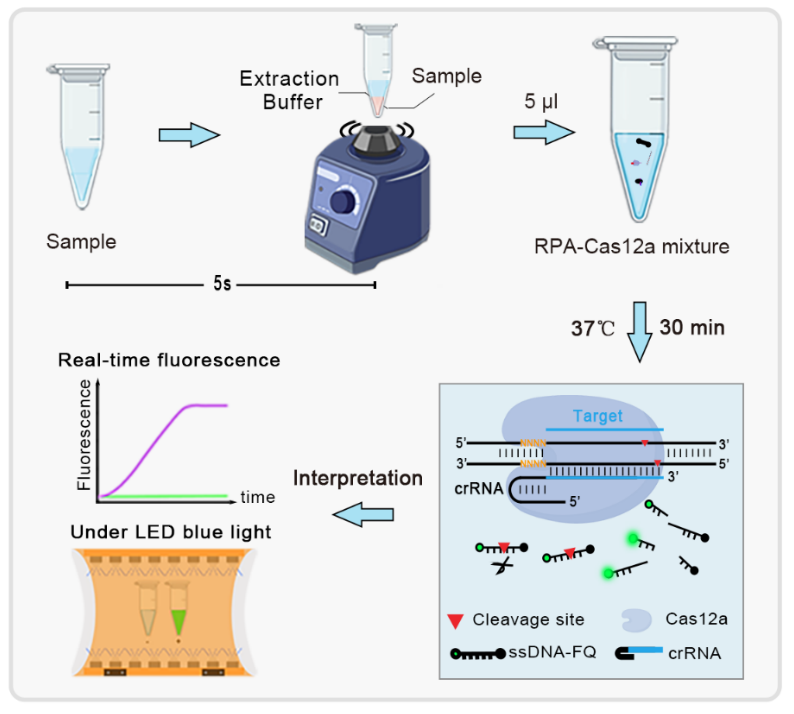
CRISPR自問世以來因其快速、敏感、特異性強、反應恒溫等特點,被廣泛的用于分(fēn)子診斷,如張鋒團隊建立的SHERLOCK核酸檢測平台、Jennifer 團隊建立的DETECTR檢測技術等。然而,這些基于CRISPR/Cas的檢測策略,crRNA的設計受到原間隔物(wù)相鄰基序位點(PAM)序列限制,且通常需要分(fēn)步驟進行,要求首先對核酸進行預擴增,然後将擴增産物(wù)轉移到CRISPR/Cas系統進行核酸檢測,這種多步驟反應方法不僅麻煩且耗時,而且容易受到氣溶膠污染的影響。爲了避免開(kāi)蓋污染這個問題,李博安團隊前期将CRISPR技術與微流控芯片結合,實現反應自動化,避免了額外(wài)的移液步驟((Sun et al., Science China-Chemistry,2022)。近期,研究團隊在進一(yī)步的研究中(zhōng)開(kāi)發了一(yī)種不受PAM限制的一(yī)步法核酸檢測技術,恒溫擴增與基因編輯檢測在同一(yī)個反應管裏進行,無需産物(wù)轉移步驟,簡單方便且敏感度高,該研究成果以題爲“Fast and visual detection of nucleic acids using a one-step RPA-CRISPR detection (ORCD) system unrestricted by the PAM”的研究論文在線發表于ANALYTICA CHIMICA ACTA。

該研究通過對CRISPR/Cas12a識别PAM和非PAM靶标的切割活性進行研究,發現與識别PAM靶标對比,Cas12a識别非PAM靶标的cis切割靶标模版的能力明顯變弱,但trans切割單鏈DNA探針的能力保持不變。研究團隊随即将CRISPR/Cas12a與RPA恒溫擴增技術結合,一(yī)步法檢測64種随機的PAM(TTTN)靶标,發現在一(yī)步CRISPR檢測中(zhōng),最優選的PAM序列TTT和含有兩個T(TTN、NTT、TNT)的靶标在ORCD中(zhōng)表現出較差的性能,而TCC、TCG、CCT、CTC、GTC和CTG在ORCD上表現出優異的活性。進一(yī)步研究發現,降低CRISPR/Cas12a的cis切割活性,使CRISPR一(yī)步檢測PAM靶标的敏感度提高了1000倍,意味着cis切割活性是CRISPR一(yī)步法檢測的關鍵。
采用非PAM序列,CRISPR一(yī)步法檢測速度快且敏感度高特異性強,30分(fēn)鍾之内能實現單拷貝的DNA和RNA檢測。并且與核酸免提取技術結合,ORCD系統可在30分(fēn)鍾内完成提取、擴增和檢測樣本,在臨床應用上檢測了82例百日咳博德特氏菌臨床樣本,與PCR相比,靈敏度和特異性分(fēn)别爲97.30%和100%。此外(wài),RT-ORCD檢測了13例SARS-CoV-2樣本,結果與RT–PCR一(yī)緻。并且僅用便攜式紫外(wài)燈或藍(lán)光燈照射即可觀察到結果。這種不受PAM限制、一(yī)步、快速、結果可視化、高敏感度和特異性的核酸檢測方法,在後疫情時代的POCT分(fēn)子診斷的未來發展中(zhōng)顯示出巨大(dà)的潛力。它可以廣泛用于在非專業環境中(zhōng)快速檢測傳染病,例如小(xiǎo)型診所、機場、田野和其他地方。
該論文的第一(yī)作者爲廈門大(dà)學生(shēng)命科學學院博士生(shēng)林康鳳,博士生(shēng)郭劍光和碩士生(shēng)郭祥舉爲本文的共同第一(yī)作者,廈門大(dà)學生(shēng)命科學學院李博安教授、廈門大(dà)學附屬第一(yī)醫院張睿博士和廈門市婦幼保健院吳謹準教授爲該文章的共同通訊作者。本項目得到國家重點研發計劃(2020YFA0112300)、國家自然科學基金(81972458,32071150)、福建省健康教育聯合研究項目(2019-WJ-34)的資(zī)助。
論文鏈接:https://doi.org/10.1016/j.aca.2023.340938
(圖/文 李博安團隊)


